醫(yī)療器械FDA認證申請辦理及費用詳情,下面為您介紹醫(yī)療器械FDA認證幾大分類及費用等問題。大家都知道美國FDA醫(yī)療器械分為3類,那它是怎么區(qū)分類別的呢?
美國FDA醫(yī)療器械分類方法,是所有出口美國企業(yè)必須面臨的問題。
美國FDA醫(yī)療器械產品目錄中共有1700多種。根據(jù)風險等級的不同,F(xiàn)DA將醫(yī)療器械分為三類(1,,II)。風險等級逐級升高,Ⅲ類風險等級高。
FDA對每一種醫(yī)療器械都明確規(guī)定了其產品分類和管理要求。首先,對于任何產品,企業(yè)都需進行企業(yè)注冊與產品列名。
I類器械一般控制(General Control)絕大部分產品只需進行注冊、列名和實施GMP規(guī)范。

I類器械一般控制(General Control)絕大部分產品只需進行注冊、列名和實施GVMP規(guī)范,產品即可進入美國市場(其中極少數(shù)產品連GMP也豁免,極少數(shù)保留產品則需向FDA遞交510(K)申這些器材只要經過一般控制就可以確保其功效與安全性,如拐杖、眼鏡片、膠布等,約占全部醫(yī)療器材的27%。
這些控制包括:禁止粗制濫造及不當標示的產品銷售:FDA得禁止不合格產品銷售必須報告FDA有關危害性、修理、置換等事項;限制某些器材的販賣、銷售、及使用;實施GMP產品
Ⅱ類產品(占46%左右)一般控制+特殊控制企業(yè)在進行注冊和列名后,這些產品除了上述一般控制之外,其余大多數(shù)產品均要求進行上市前通告。
少量的Ⅱ類產品可以給免上市前通告程序。生產企業(yè)須在產品上市前90天向FDA提出申請,通過510K審后,產品才能夠上市銷售。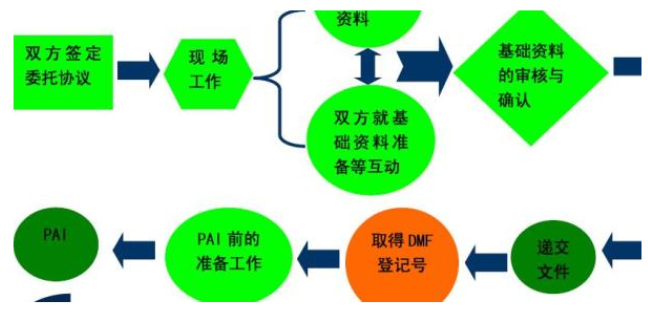
Ⅲ類產品(占7%左右)一般控制+上市前許可企業(yè)在進行注冊和列名后,須實施GMP并向FDA認證遞交PMA申請(部分山類產品還是PmN)。
一般來說,Ⅲ類產品多為維持、支持生命或植入體內的器材,對病患具有潛在危險,可能引起傷害或疾病者,如心律調節(jié)器、子言內器材及嬰兒保溫箱等,約占所有器材的8%。這些器材必須取得FDA的PMA之后方能銷售。
對類產品,企業(yè)向FDA遞交相關資料后,F(xiàn)DA只進行公告,并無相關證件發(fā)給企業(yè);對Ⅱ、Ⅲ類器械,企業(yè)須遞交PMN或PMA,F(xiàn)DA在公告的同時,會給企業(yè)以正式的市場準入批準函件(Clearance),即允許企業(yè)以自己的名義在美國醫(yī)療器械市場上直接銷售其產品。
至于申請過程中是否到企業(yè)進行現(xiàn)場GMP考核,則由FDA根據(jù)產品風險等級、管理要求和市場反饋等綜合因素決定。
綜合以上內容可知,絕大部分產品在進行企業(yè)注冊、產品列名和實施GlMP,或再遞交510(K)申請后,即可獲得FDA批準上市。
醫(yī)療器械FDA認證申請辦理及費用詳情,深圳訊科商品檢驗是國內知名的FDA認證代辦機構,是醫(yī)療器械檢測認證上有多年的經驗,下面為您介紹醫(yī)療器械FDA認證幾大分類及費用等問題。大家都知道美國FDA醫(yī)療器械分為3類,那它是怎么區(qū)分類別的呢?
美國FDA醫(yī)療器械分類方法,是所有出口美國企業(yè)必須面臨的問題。
美國FDA醫(yī)療器械產品目錄中共有1700多種。根據(jù)風險等級的不同,F(xiàn)DA將醫(yī)療器械分為三類(1,,II)。風險等級逐級升高,Ⅲ類風險等級高。
FDA對每一種醫(yī)療器械都明確規(guī)定了其產品分類和管理要求。首先,對于任何產品,企業(yè)都需進行企業(yè)注冊與產品列名。
I類器械一般控制(General Control)絕大部分產品只需進行注冊、列名和實施GMP規(guī)范。
I類器械一般控制(General Control)絕大部分產品只需進行注冊、列名和實施GVMP規(guī)范,產品即可進入美國市場(其中極少數(shù)產品連GMP也豁免,極少數(shù)保留產品則需向FDA遞交510(K)申這些器材只要經過一般控制就可以確保其功效與安全性,如拐杖、眼鏡片、膠布等,約占全部醫(yī)療器材的27%。
這些控制包括:禁止粗制濫造及不當標示的產品銷售:FDA得禁止不合格產品銷售必須報告FDA有關危害性、修理、置換等事項;限制某些器材的販賣、銷售、及使用;實施GMP產品(占46%左右)一般控制+特殊控制企業(yè)在進行注冊和列名后,這些產品除了上述一般控制之外,其余大多數(shù)產品均要求進行上市前通告。
少量的Ⅱ類產品可以給免上市前通告程序。生產企業(yè)須在產品上市前90天向FDA提出申請,通過510K審后,產品才能夠上市銷售。
Ⅲ類產品(占7%左右)一般控制+上市前許可企業(yè)在進行注冊和列名后,須實施GMP并向FDA認證遞交PMA申請(部分山類產品還是PmN)。
一般來說,Ⅲ類產品多為維持、支持生命或植入體內的器材,對病患具有潛在危險,可能引起傷害或疾病者,如心律調節(jié)器、子言內器材及嬰兒保溫箱等,約占所有器材的8%。這些器材必須取得FDA的PMA之后方能銷售。
對類產品,企業(yè)向FDA遞交相關資料后,F(xiàn)DA只進行公告,并無相關證件發(fā)給企業(yè);對Ⅱ、Ⅲ類器械,企業(yè)須遞交PMN或PMA,F(xiàn)DA在公告的同時,會給企業(yè)以正式的市場準入批準函件(Clearance),即允許企業(yè)以自己的名義在美國醫(yī)療器械市場上直接銷售其產品。
至于申請過程中是否到企業(yè)進行現(xiàn)場GMP考核,則由FDA根據(jù)產品風險等級、管理要求和市場反饋等綜合因素決定。
綜合以上內容可知,絕大部分產品在進行企業(yè)注冊、產品列名和實施GlMP,或再遞交510(K)申請后,即可獲得FDA批準上市。
醫(yī)療器械FDA認證申請辦理及費用詳情,歡迎您直接來電4000-199-838咨詢我司工作人員,獲得詳細的信息。值得您的信賴與支持!



